পর্যায় সারণী হল রসায়ন শাস্ত্রের একটি মৌলিক হাতিয়ার, যা পদার্থ গঠন করে এমন উপাদানগুলোর একটি তাৎপর্যপূর্ণ উপস্থাপনা হিসাবে কাজ করে। এটি এমন একটি তালিকা যা পরমাণুসমূহের পারমাণবিক গঠন এবং রাসায়নিক বৈশিষ্ট্যের উপর ভিত্তি করে সমস্ত পরিচিত উপাদানগুলির একটি পদ্ধতিগত বিন্যাস উপস্থাপন করে। সময়ের সাথে সাথে একাধিক বিজ্ঞানীদের দ্বারা বিকশিত ও সংশোধিত পর্যায় সারণী আমাদেরকে এখন পর্যন্ত আবিস্কৃত মৌলিক পদার্থসমূহকে বুঝতে এবং অধ্যয়ন করতে সাহায্য করে। এই লেখাটিতে আমরা পর্যায় সারণীর ইতিহাস, গঠন এবং তাৎপর্য সম্পর্কে জানব, সেই সাথে এর মধ্যে রসায়ন পাঠের রহস্যগুলো উন্মোচন করব।
পর্যায় সারণী কি?
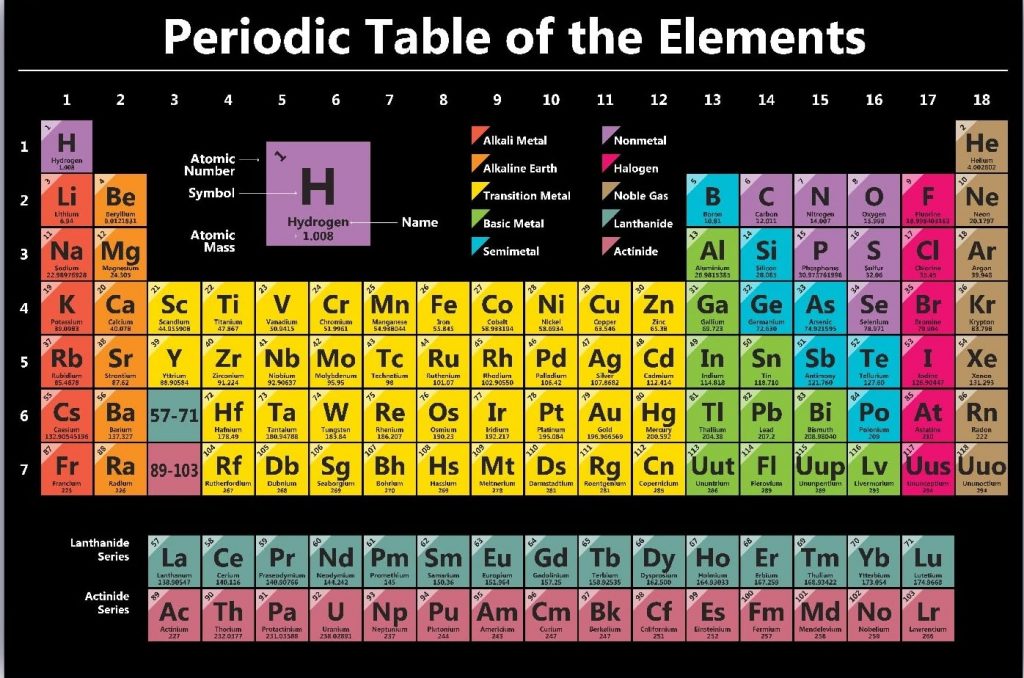
একই ধর্ম বিশিষ্ট মৌলসমূহকে একই শ্রেণীভুক্ত করে আবিস্কৃত সকল মৌলকে স্থান দিয়ে মৌলসমূহের যে সারণি বা ছক বর্তমানে প্রচলিত আছে তাকে পর্যায় সারণি বলে। সহজ কথায়- বিভিন্ন মৌলের ক্রমপরিবর্তন দেখানোর প্রয়াসে মৌলসমূহকে যে সারণিতে সাজানো হয়, তাকে পর্যায় সারণি বলা হয়।
পর্যায় সারণি হলাে ছকের মাধ্যমে প্রকাশিত রাসায়নিক মৌলসমূহের ধর্মের একটি ধারণাচিত্র। 2012 সাল পর্যন্ত সর্বমােট 118 টি মৌল শনাক্ত হয়েছে। প্রত্যেক মৌলের ধর্ম, বৈশিষ্ট্য বা আচরণ আলাদাভাবে আয়ত্ত করা একেবারেই অসম্ভব। তাই পর্যায় সারণিতে অল্প পরিসরে মৌলসমূহকে তাদের ধর্মের ভিত্তিতে ভাগ করা হয়েছে, যাতে করে পর্যায় সারণিতে কোন মৌলের অবস্থান দেখেই আমরা মৌলটির রাসায়নিক ও ভৌত ধর্ম, এর বৈশিষ্ট্য এবং আচরণ সম্পর্কে স্পষ্ট ধারণা পেতে পারি।
পর্যায় সারণীর ইতিহাস
পর্যায় সারণির ইতিহাস 19 শতকের গোড়ার দিকে খুঁজে পাওয়া যায়, যখন বিজ্ঞানীরা ক্রমবর্ধমান সংখ্যক মৌল আবিষ্কার এবং সনাক্ত করতে শুরু করেছিলেন। দিমিত্রি মেন্ডেলিভ, একজন রাশিয়ান রসায়নবিদ, 1869 সালে পর্যায় সারণীর প্রথম সংস্করণ তৈরি করার জন্য কৃতিত্ব পান। যে কারণে দিমিত্রি মেন্ডেলিভ কে পর্যায় সারণীর জনক বলা হয়ে থাকে। তিনি মৌলসমূহকে পারমাণবিক ভরের ক্রমবর্ধমান ক্রম অনুসারে সাজিয়েছিলেন এবং পর্যবেক্ষণ করেছিলেন যে অনুরূপ বৈশিষ্ট্যযুক্ত মৌলিসমূহ নিয়মিত বিরতিতে উপস্থিত হয়। এই বিন্যাসটি পরবর্তীকালে আধুনিক পর্যায় সারণীতে পরিণত হওয়ার ভিত্তি স্থাপন করেছিল।
1789 সালে বিজ্ঞানী ল্যাভয়শিয়ে ভৌত অবস্থার উপর ভিত্তি করে, 1864 সালে ইংরেজ বিজ্ঞানী জন নিউল্যান্ড মৌলসমূহের ভর অনুযায়ী, 1869 সালে রুশ বিজ্ঞানী ডিমিট্রি ম্যান্ডেলিফ পারমাণবিক ভর অনুসারে ও 1913 সালে বিজ্ঞানী হেনরি মোসলে পারমাণবিক সংখ্যার উপর ভিত্তি করে পর্যায় সারণি প্রস্তাব করেছেন যা নানা পরিবর্তনের মধ্য দিয়ে বর্তমান পর্যায় সারণির রূপ লাভ করেছে।
পর্যায় সারণীর গঠন
পর্যায় সারণী মূলত সারি এবং কলামে সংগঠিত হয়, যাদের আমরা যথাক্রমে পর্যায় এবং গ্রুপ হিসাবে উল্লেখ করে থাকি। প্রতিটি অনুভূমিক সারি একটি পর্যায় নির্দেশ করে, এবং প্রতিটি উল্লম্ব কলাম একটি গ্রুপ প্রতিনিধিত্ব করে। একই গ্রুপের মধ্যে উপাদানগুলো অনুরূপ রাসায়নিক বৈশিষ্ট্য প্রদর্শন করে, যেখানে একই পর্যায়ের উপাদানগুলি পারমাণবিক কাঠামোর একটি পুনরাবৃত্ত প্যাটার্ন প্রদর্শন করে।
পর্যায় সারণীতে মৌলসমূহ সাধারণত পারমাণবিক সংখ্যা বৃদ্ধির ক্রমানুসারে তালিকাভুক্ত করা হয়, যা একটি পরমাণুর নিউক্লিয়াসে পাওয়া প্রোটনের সংখ্যা দ্বারা নির্ধারিত হয়। পারমাণবিক সংখ্যা একটি মৌলের পরিচয় এবং বৈশিষ্ট্য নির্ধারণ করে, যা কি না পর্যায় সারণির বিন্যাসে একটি গুরুত্বপূর্ণ ফ্যাক্টর।
পর্যায়
পর্যায় সারণির আনুভূমিক সারিগুলোকে পর্যায় বা Period বলে। বর্তমান পর্যায় সারণিতে মোট ৭টি পর্যায় আছে। প্রতিটি পর্যায়ের মৌলগুলোর ধর্ম অভিন্ন তবে ক্রমপরিবর্তনশীল হয়। যেমন-একই পর্যায়ে যতই ডানদিক যাওয়া যায়, ততই মৌলসমূহের মধ্যে ধাতুধর্ম হ্রাস পায় ও পরমাণুর আকার ছোট হয়।
গ্রুপ
পর্যায় সারণির লম্ব স্তম্ভগুলোকে বা উল্লম্ব সারিগুলোকে শ্রেণি বা Group বলে। সদৃশ ধর্মের মৌলগুলো একটি শ্রেণিতে স্থান পায়। বর্তমান পর্যায় সারণিতে মোট 18টি গ্রুপ আছে। আগে পর্যায় সারণির এ 18টি গ্রুপকে রোমান হরফের সংখ্যা I থেকে VIII দ্বারা প্রকাশ করা হতো। সপ্তম শ্রেণির পরের শ্রেণিকে শূন্য শ্রেণি বলা হতো। পূর্বের এ শ্রেণিকরণকে সর্বশেষ পর্যায় সারণির সংস্করণে 18টি গ্রুপে ভাগ করে পুনর্বিন্যাস করা হয়েছে যা IUPAC কর্তৃক গৃহীত হয়েছে।
পর্যায় সারণির ভিত্তি
পর্যায় সারণি সৃষ্টির সময় মৌলসমূহের পারমাণবিক ভরকে ভিত্তি ধরা হয়েছিল। পরবর্তীতে পারমাণবিক সংখ্যাকে ভিত্তি ধরা হয়। বর্তমানে একথা স্বীকৃত যে পর্যায় সারণির সত্যিকার ভিত্তি হচ্ছে মৌলসমূহের ইলেকট্রন বিন্যাস। প্রতিনিধিত্বমূলক মৌলসমূহের ইলেকট্রন বিন্যাসে সর্বশেষ স্তরে যতটি ইলেকট্রন বিদ্যমান, তা থেকে পর্যায় সারণিতে মৌলটির অবস্থান কত নম্বর গ্রুপে তা হিসাব করা যায়। আর ইলেকট্রন বিন্যাসে যতটি স্তর আছে মৌলটির অবস্থান তত নম্বর পর্যায়ে।
পরমাণুর ইলেকট্রন বিন্যাস থেকে পর্যায় সারণিতে কয়েকটি মৌলের অবস্থান নির্ণয়
নিচে একটি ছকের মাধ্যমে কিছু উদাহরণ দেখানো হলো :

পর্যায়ক্রমিক ধর্ম
পর্যায় সারণীর বিন্যাস মৌলসমূহের বৈশিষ্ট্যের বেশ কয়েকটি গুরুত্বপূর্ণ দিক প্রকাশ করে থাকে। যেমন-
ক. পারমাণবিক ব্যাসার্ধ: একটি পর্যায়ের বাম থেকে ডানে সরে গেলে লক্ষ্য করা যায় যে পরমাণুটির সর্ববহিস্থ স্তরে একটি করে ইলেকট্রন ক্রমান্বয়ে বাড়ছে। সর্ববহিস্থ স্তরে ঋণাত্মক চার্জযুক্ত এই ইলেকট্রন সংখ্যার বৃদ্ধির জন্য নিউক্লিয়াসের ধনাত্নক চার্জ দ্বারা অধিক আকর্ষিত হতে থাকে। ফলে পারমাণবিক ব্যাসার্ধ বর্ধিত পারমাণবিক চার্জের কারণে হ্রাস পায়। আবার একই গ্রুপে উপর থেকে নিচের দিকে গেলে ক্রমান্বয়ে একটি করে ইলেকট্রন শেল বা শক্তিস্তর বাড়তে থাকে। ফলে পারমাণবিক ব্যাসার্ধ বাড়তে থাকে।
খ. তড়িৎ ঋণাত্মকতা: ইলেক্ট্রোনেগেটিভিটি একটি নির্দিষ্ট পর্যায়ে ক্রমানুসারে বাড়তে থাকে এবং একটি গ্রুপে হ্রাস পেতে থাকে।
গ. আয়নাইজেশন: আয়নাইজেশন শক্তি সাধারণত একটি পর্যায়ে বাম থেকে ডানে বৃদ্ধি পায় এবং একটি গ্রুপে হ্রাস পায়, কারণ একটি ছোট এবং শক্তভাবে আবদ্ধ পরমাণু থেকে একটি ইলেকট্রন অপসারণ করতে বেশি শক্তির প্রয়োজন হয়।
পর্যায় সারণীর তাৎপর্য
পর্যায় সারণী বিশ্বব্যাপী রসায়নবিদ এবং গবেষকদের জন্য একটি শক্তিশালী হাতিয়ার। রসায়ন পাঠ ও গবেষণায় এর অপরিসীম তাতপর্য রয়েছে। যেমন-
১. পদার্থের ভবিষ্যদ্বাণী: পর্যায় সারণীর ফাঁকা স্থানগুলো বিজ্ঞানীদের অনাবিষ্কৃত উপাদানগুলোর অস্তিত্ব এবং বৈশিষ্ট্য সম্পর্কে ধারণা দেয়। যেহেতু পর্যায় সারণী তে উপদানগুলো একটি পর্যায়ক্রমিক ধর্ম প্রদর্শন করে, তাই তা থেকে অনাবিস্কৃত মৌলসমূহের ভবিষ্যদ্বাণী পাওয়া যায় এবং নতুন উপাদানগুলির জন্য তাদের অনুসন্ধানের পথ দেখায়।
২. মৌলের পারস্পারিক সম্পর্ক বোঝা: পর্যায় সারণী বিজ্ঞানীদের বিভিন্ন মৌলের মধ্যে সম্পর্ক এবং সাদৃশ্য বুঝতে সাহায্য করে, যা রাসায়নিক বিক্রিয়া এবং পদার্থের পারস্পারিক মিথষ্ক্রিয়া সম্পর্কে ধারণা দিয়ে থাকে।
৩. রাসায়নিক নামকরণ: পর্যায় সারণী রাসায়নিক যৌগের নামকরণ এবং শ্রেণিবদ্ধকরণে সহায়তা করে।
শেষ কথা
পর্যায় সারণী বিজ্ঞানের ইতিহাসে সবচেয়ে উল্লেখযোগ্য অর্জনগুলোর একটি হিসাবে বিবেচনা করা হয়, যা পদার্থের গঠন বোঝার জন্য একটি কাঠামো প্রদান করে। 19 শতকে এর সূচনালগ্ন থেকে আধুনিক রসায়নে এর ভূমিকা অপরিহার্য। পর্যায় সারণী আমাদেরকে বিভিন্ন পদার্থ এবং তাদের মিথস্ক্রিয়াকে উপলব্ধি করার উপায়কে আকৃতি প্রদান করেছে। পর্যায় সারণী ভবিষ্যতের বৈজ্ঞানিক প্রচেষ্টাকে পরিচালনা করার জন্য সীমাহীন সম্ভাবনার দ্বার উন্মুক্ত করে দিয়েছে। নতুন উপাদান এবং আবিষ্কারের আবির্ভাব হওয়ার সাথে সাথে, পর্যায় সারণী নিঃসন্দেহে বিকশিত হবে।











0 মন্তব্যসমূহ
If it seems any informative mistake in the post, you are cordially welcome to suggest fixing it.